Späte Einsicht: Die Genomforschung wendet sich seltenen Krankheiten zu
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für Biophysik
Einführung
Seit Mitte der 1990er-Jahre stehen häufige Krankheiten im Mittelpunkt der Genomforschung. Unter der eingängigen, aber unbewiesenen Common Disease – Common Variant (CD/CV)-Hypothese, also der Annahme, dass es für häufige Krankheiten auch häufige genetische Risikofaktoren geben muss, sind seither mehrere Milliarden Dollar in die Suche nach genetischen Markern geflossen, die mit Altersdemenz, Diabetes, Autismus, Herz- und Kreislaufkrankheiten oder Bluthochdruck assoziiert sind. An Warnungen, dass dies der falsche Weg sein könnte, hat es von Anfang an nicht gefehlt, auch nicht, als sich die Bundesregierung im Jahre 2001 entschloss, ein eigenes, finanziell großzügig ausgestattetes Genomforschungsprogramm aufzulegen und es nach amerikanischem Vorbild ganz auf häufige Krankheiten auszurichten [1]. Aufgrund der Vielzahl überaus optimistischer Vorhersagen prominenter Befürworter dieser Forschungsrichtung wurden jene Stimmen jedoch nur selten gehört. Noch im Jahre 2005 erklärte Francis Collins, damals Leiter des amerikanischen National Human Genome Research Institute (NHGRI) und heute Präsident der National Institutes of Health (NIH), es sei wahrscheinlich, dass es bis zum Jahre 2010 für ein Dutzend häufiger Krankheiten prädiktive genetische Tests geben werde [2]. Tatsächlich wurden nur wenige Jahre später für eine ganze Reihe häufiger Krankheiten signifikant assoziierte genetische Marker gefunden – jedoch erst nach Typisierung vieler Hunderttausend DNA-Marker bei mehreren Tausend Patienten und gesunden Individuen. Bei der durch diese Befunde ausgelösten Euphorie ging die Tatsache unter, dass die allermeisten dieser Marker das Krankheitsrisiko nur minimal beeinflussen und daher für die Diagnose und Prognose ohne Bedeutung sind. Auch die Hoffnung, dass diese Marker Einsichten in die molekulare Pathogenese der assoziierten Krankheiten ermöglichen würden, hat sich nur in den seltensten Fällen erfüllt.
Warum die Erforschung komplexer Krankheiten schwierig ist
Für diese ernüchternde Bilanz gibt es jedoch plausible Gründe, wie schon vor Jahren erläutert [3]. Erstens scheinen Faktoren wie Ernährungsgewohnheiten, aber auch sogenannte epigenetische Faktoren und zufällige Ereignisse bei der Entstehung häufiger Krankheiten eine bedeutendere Rolle zu spielen als früher angenommen. Zweitens gibt es für die allermeisten Volkskrankheiten offenbar keine häufigen genetischen Risikofaktoren – die CD/CV-Hypothese ist also falsch. Für die geistige Behinderung und den Autismus, aber auch für die Schizophrenie lässt sich dies besonders einfach dadurch erklären, dass die Betroffenen meistens keine oder nur wenige Kinder haben; deshalb können sich die verantwortlichen genetischen Faktoren gar nicht in der Bevölkerung verbreiten. Schließlich sind häufige Krankheiten oft genetisch heterogen: Viele klinisch einheitliche Krankheitsbilder können durch ganz verschiedene monogene Defekte hervorgerufen werden. Ein extremes Beispiel dafür ist die geistige Behinderung. Durch systematische Untersuchung betroffener Familien konnten allein auf dem menschlichen X-Chromosom bereits Veränderungen in etwa hundert Genen als Krankheitsursache identifiziert werden, und die Gesamtzahl der Gendefekte, die zu geistiger Behinderung führen können, dürfte in die Tausende gehen [4].
Ein überfälliger Kurswechsel
Angesichts der vollständigen Ausrichtung großer Genomzentren, staatlicher Förderorganisationen und der Pharmaindustrie auf die Erforschung von Volkskrankheiten dauerte es jedoch noch mehrere Jahre, bis auch die letzten Verfechter dieser Forschungsrichtung zum Kurswechsel bereit waren. Aber im Januar 2012 war es soweit: Auch Eric Lander, der Gründer des BROAD-Instituts in Boston und einer der prominentesten Verteidiger dieses Konzepts weltweit, gab sich endlich geschlagen. In seiner jüngsten Publikation [5] erklärt er die vergebliche Suche nach häufigen Risikofaktoren für Volkskrankheiten dadurch, dass genetische Faktoren bei diesen Krankheiten eine viel geringere Rolle spielen als früher angenommen. Ob und wann diese Einsichten auch die deutsche Bundesregierung zu einer Neuausrichtung veranlassen werden, muss allerdings abgewartet werden: Noch im Herbst 2011 erklärte das zuständige Ministerium, die medizinische Forschung auch in Zukunft ganz auf häufige Krankheiten ausrichten zu wollen.
Andere Länder und Forschungsorganisationen haben den erforderlichen Kurswechsel bereits vollzogen. So hat das National Human Genome Research Institute der USA im Dezember 2011 insgesamt 416 Millionen US-Dollar für die Erforschung seltener, genetisch bedingter Krankheiten zur Verfügung gestellt [6]. Auch der Traum der Pharmaindustrie, genetische Marker seien der Schlüssel für die Entwicklung von „Blockbuster Drugs“ zur Behandlung häufiger Krankheiten, ist schon lange ausgeträumt. Seit sich herausgestellt hat, dass häufige Krankheitsbilder viele verschiedene molekulare Ursachen haben können, setzt die internationale Genomforschung zunehmend auf die Erforschung von Krankheiten, die auf einzelne Gendefekte zurückgehen und nach den Mendelschen Regeln vererbt werden, also auf sogenannte monogene Krankheiten [7]. Zum Teil geschieht dies in der Erwartung, dadurch mehr über komplexe Krankheiten zu erfahren, aber immer öfter auch wegen der großen Bedeutung seltener Krankheiten für die Krankenversorgung und unsere Gesellschaft allgemein. Auch die Entwicklung neuer und preiswerter Verfahren für die DNA-Sequenzierung hat das Interesse an monogenen Krankheiten beflügelt, zumal die Einführung dieser Methoden in die Klinik unmittelbar bevorsteht, mit weitreichenden Konsequenzen für die Diagnose, Prävention und Therapie genetisch bedingter Störungen.
Systematische Aufklärung monogener Krankheiten mithilfe neuer Sequenzierungstechniken
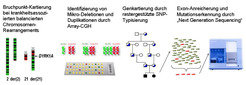 Bild vergrößern
Bild vergrößern
Gegen den allgemeinen Trend hat sich die Abteilung Molekulare Humangenetik seit ihrer Gründung mit der Erforschung monogener Krankheiten befasst (Abb. 1). Im Mittelpunkt stand dabei die geistige Behinderung, eines der größten ungelösten Probleme im Bereich der Krankenversorgung, wofür weitaus mehr staatliche Mittel aufgewendet werden als für alle Formen von Krebs zusammen [8]. Schwere Formen der geistigen Behinderung gehen in den meisten Fällen auf Defekte einzelner Gene oder auf chromosomale Veränderungen zurück. Mit Unterstützung der Max-Planck-Gesellschaft, der Europäischen Union und des Bundesministeriums für Bildung und Forschung haben Mitarbeiter der Abteilung Molekulare Humangenetik im vergangenen Jahrzehnt maßgeblich zur Aufklärung der molekularen Ursachen kognitiver Störungen beigetragen. Ein Schlüssel dafür waren langjährige Kooperationen mit europäischen und außereuropäischen Partnern zur Rekrutierung betroffener Patienten und Familien und die Etablierung effizienter Verfahren zur genauen Lokalisierung der betreffenden Gendefekte im menschlichen Genom. Untersuchungen an blutsverwandten Familien aus dem Iran führten zu der Erkenntnis, dass es neben X-chromosomalen Ursachen eine weit größere Zahl anderer Gendefekte gibt, die Störungen der Hirnfunktion zur Folge haben. In der Folgezeit gelang es, mehrere dieser rezessiv vererbten Formen der geistigen Behinderung aufzuklären.
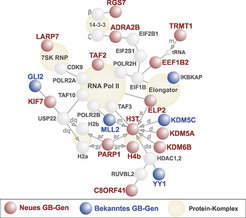 Bild vergrößern
Bild vergrößern
Die Einführung von Hochdurchsatzverfahren zur DNA-Sequenzierung hat die Suche nach genetischen Defekten im menschlichen Genom und damit die Aufklärung von Ein-Gen-Krankheiten außerordentlich erleichtert und beschleunigt. Durch Sequenzierung aller X-chromosomalen Gene in 250 Familien mit X-chromosomaler geistiger Behinderung konnten Mitarbeiter der Abteilung Molekulare Humangenetik gemeinsam mit europäischen und australischen Kooperationspartnern über ein Dutzend neuer molekularer Ursachen für dieses Krankheitsbild identifizieren (Abb. 2, [9]). Noch spektakulärer war das Ergebnis der Sequenzierung von 136 blutsverwandten Familien mit geistiger Behinderung aus dem Iran [10]: Bei 78 dieser Familien gelang es, den verantwortlichen Gendefekt zu finden. Auf diese Weise konnten 50 neue Gene für rezessiv vererbte kognitive Störungen identifiziert werden. Eine ganze Reihe der von diesen Genen kodierten Eiweiße interagieren direkt mit den Produkten bereits bekannter Gene für geistige Behinderung. Viele sind an grundlegenden zellulären Prozessen wie der Übersetzung von DNA in Proteine oder dem Energiestoffwechsel beteiligt, die für die Hirnfunktion offenbar besonders wichtig sind.
Diese Untersuchungen, die bislang umfangreichsten ihrer Art, belegen, dass der systematischen Aufklärung aller Ein-Gen-Krankheiten beim Menschen prinzipiell nichts mehr im Wege steht und dass sich dieses Ziel mit relativ bescheidenem Mitteleinsatz erreichen lässt – jedenfalls im Vergleich zu den enormen Aufwendungen für die Suche nach genetischen Risikofaktoren während des vergangenen Jahrzehnts.